ASTCT-CIBMTR 2024 | 刘华颖主任:TDH移植策略在儿童R/R ALL中“承前启后”的创新探索
2024-2-24

近年来,造血干细胞移植技术不断取得突破,正朝着更有效、更安全的治愈目标不断前行。与传统移植技术相比,半相合异基因造血干细胞移植T细胞清除术(TDH)具有移植死亡率低、排异反应发生率低、血细胞输注需求少、合并症发生风险低、安全性良好等优势,已成为近年来备受关注的移植方案。
近日于美国圣安东尼奥召开的2024年ASTCT-CIBMTR移植与细胞治疗年会上,高博医学(血液病)广东研究中心南方春富(儿童)血液病研究院刘华颖主任在大会口头报告环节分享了TDH移植策略的创新探索成果,为全球儿童R/R ALL治疗领域面临的复发困境带来新思路与新希望。本篇带来该项研究的访谈与解读。

刘华颖主任在ASTCT-CIBMTR移植与细胞治疗年会上作口头报告

Tandem Meetings ASTCT-CIBMTR移植和细胞治疗会议,是美国移植与细胞治疗学会(ASTCT)和国际血液和骨髓移植研究中心(CIBMTR)联合举办的年度会议。
Q1
首先,能否请您简要介绍一下开展该研究的背景与初衷?
刘华颖主任:我们以往的探索已经表明,CAR-T治疗后桥接TDH移植能够改善儿童R/R B-ALL的无GVHD/无复发生存期,整体治疗效果显著。相关研究在2022年美国血液病年会(ASH2022)作为Poster进行了展示。
在此基础上,我们希望去探索和解决儿童恶性血液病中临床诊疗最为头痛的问题——复发,让TDH方案在儿童血液病中发挥更大的治疗优势与价值。因此,针对TDH在临床实践中的前后环节,我们进行了周密的思考与规划,并开展了本项研究。
Q2
本研究作为本届年会备受关注的口头报告,其治疗方案的设计基于哪些考量?有哪些亮点?
刘华颖主任:瞄准复发难题,TDH的前后环节都值得下功夫。“前”,即如何在移植前让患儿得到更深度的缓解;“后”,即如何通过持续诱导移植物抗白血病(GVL)效应,去达到维持治疗的目的。
本研究的亮点在于治疗方案的设计,将CAR-T和半相合供者淋巴细胞输注(haplo-DLI)两种久经临床考验的免疫治疗手段,一前一后与TDH创新性地联合起来。基于这种理念,我们针对儿童R/R ALL,在TDH“前”通过CAR-T治疗以获得更深度的缓解,并在TDH“后”采用了剂量递增的haplo-DLI以持续性地诱导GVL效应,而TDH也成为了“承前启后”的关键节点。
结果显示,入组的患儿接受研究的治疗方案后,只出现1例复发,总生存(OS)率和无白血病生存(LFS)率分别为89.1%和85.5%。在安全性方面,所有患儿均未接受任何移植后的GVHD预防治疗,仅出现皮肤表现的aGVHD(13例为Ⅰ级,1例为Ⅱ级),且无一例患儿发展为Ⅲ/Ⅳ级;2例患儿出现局限性cGVHD(仅皮肤),无一例患儿出现广泛性cGVHD。这种联合方案不仅更好、更安全地解决了患儿的移植需求,而且能够切实降低复发,真正解决临床问题。
Q3
随着本研究的初步探索成果公布,您未来有哪些研究规划?
刘华颖主任:我们还对接受研究方案的患儿进行了深入分析,发现处于高危状态需要进行移植桥接的患儿,采用该方案获益可能会更多。对于患儿群体而言,究竟哪些患儿能够从CAR-T治疗中获益,哪些患儿在CAR-T治疗后需要桥接移植等问题,未来会需要一个更大、更深入的研究去评估,从而指导临床决策去针对特定的患儿群体,在CAR-T获益后尽早去桥接移植,避免延误宝贵的治疗时机。
TDH方案在国际上运用至今已有二十年,但在国内尚未得到大规模的普及,目前国内仅有少数医院在开展临床应用。我们中心是目前国内应用TDH方案经验最为丰富的移植中心之一,并且已经在地中海贫血等非恶性血液病领域取得了丰硕的研究与实践成果。近年来,我们也不懈挖掘TDH方案在中国儿童恶性血液病中的治疗潜力,以期通过与创新理念、关键技术、前沿手段的联合,持续探索更大的治疗价值与获益。

研究摘要


摘要号:49
CAR-T治疗后桥接TDH移植并给予预防性Haplo-DLI输注:降低儿童R/R-ALL的复发率并改善移植结果
作者
刘华颖,王静,陈德俊,陈丹,何岳林,李春富
单位
高博医学(血液病)广东研究中心南方春富(儿童)血液病研究院
背景
TDH是治疗儿童R/R-ALL的一种很有前景的选择。然而,疾病复发仍然是治疗失败的主要原因。我们探索了一种新的方案,在CAR-T治疗后桥接TDH移植,并给予预防性haplo-DLI,从而减少复发并改善移植结果。
方法
2020年9月至2023年6月,共计37例接受移植的R/R-ALL患儿被纳入本研究。患儿的中位年龄为6(1-15)岁,男女比例为18:19。其中,35例B-ALL患儿接受CD19单靶点CAR-T治疗,或CD19序贯CD22 CAR-T输注;2例T-ALL患儿接受CD7 CAR-T治疗。从CAR-T治疗到移植的中位时间为39(23-380)天。所有患儿都接受了清髓的预处理方案。预处理方案包括环磷酰胺(1×50 mg/kg,−10天,-3至-2天),氟达拉滨(1×40 mg/m2,-7至-4天),噻替哌(2×5 mg/kg,-4天),白消安(90 mg/m2,-7至-5天),抗胸腺细胞球蛋白(ATG-F)(1×15 mg/kg,-9至-8天)。TCRαβ清除移植物包括中位数为26.5(13.9-114.3)×106 CD34+细胞/kg,98.33(34.97-275.2)×106 NK细胞/kg,28.6(12.3-142.4)×106 TCRδγ+T细胞/kg。所有患儿均未接受任何移植后的GVHD预防治疗。从移植后第54(41-217)天开始,每月以1.8(0.5-2.7)×105 CD3+T细胞/kg的递增剂量给予预防性haplo-DLI输注。
结果
患儿的中位随访时间为431(16-1062)天。中性粒细胞和血小板植入的中位时间分别为17(10-22)天和9(6-12)天。3例患儿初次移植失败,其中2例患儿在重新调整方案和二次Haplo-HSCT后获救。36/37例患儿最终植入。共计32例患儿接受了每月递增剂量的haplo-DLI输注。
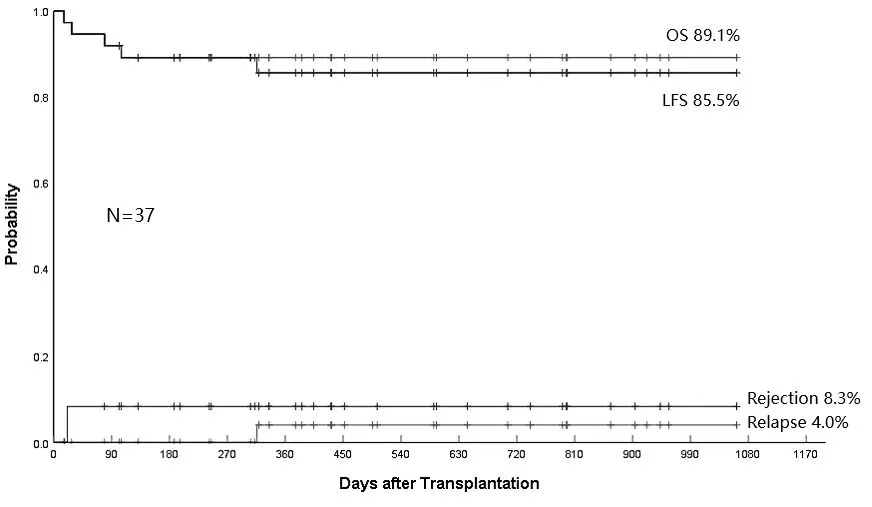
14例患儿出现了仅皮肤表现的aGVHD(13例为Ⅰ级,1例为Ⅱ级),无一例患儿发展为Ⅲ/Ⅳ级。2例患儿出现局限性cGVHD(仅皮肤),无一例患儿出现广泛性cGVHD。aGVHD和cGVHD的累计发生率分别为43.7%和6.3%(均为局限性)。OS率和LFS率分别为89.1%和85.5%。4例患儿死亡,非复发死亡率的累计发生率为10.9%,1例患儿在移植后10个月复发(仍存活),累计复发率为4%。
结论
研究数据表明TDH是R/R-ALL患儿合适的治疗选择。CAR-T治疗后桥接TDH移植并给予剂量递增的Haplo-DLI输注,能够降低儿童R/R-ALL的复发率,改善LFS。
专家介绍

刘华颖副主任医师
高博医学(血液病)广东研究中心南方春富(儿童)血液病研究院
血液病数字诊疗专委会第一届委员会委员
中国女医师协会第一届靶向专业委员会委员
广东省精准医学应用学会自身免疫病分会委员
广东省地中海贫血防治协会地贫治疗专业委员会委员
广东省抗癌协会小儿肿瘤专业委员会第一届青年委员会委员
广东省妇幼保健协会脐带血应用专业委员会第二届委员会委员
从事儿科临床、教学及科研工作16年余。2016年美国洛杉矶希望之城国际癌症研究与治疗中心的访问学者。2017年“宋庆龄儿科医学奖”集体获得者之一。主要研究方向为儿童急性淋巴细胞白血病,儿童淋巴瘤等血液性疾病的诊断与治疗,CAR-T细胞免疫治疗及造血干细胞移植。
预约挂号
您是否准备好预约了?如有任何问题,可随时与我们联系。
电话:400-165-9966











 电话:4001659966
电话:4001659966